371. Khi đốt cháy hoàn toàn 20g hỉđro thu được 180g hơi nước. Nếu phân huỷ hoàn toàn 20g nước thu được 4,44g hiđro. Những số liệu trên có phù hợp với định luật thành phần không đổi không?
A. Có, cả hai trường hợp đều phù hợp.
B. Không, cả hai trường hợp đều không phù hợp.
C. Trường hợp một phù hợp, trường hợp hai không phù hợp.
D. Trường hợp một không phù hợp, trường hợp hai phù hợp.
372. Hoà tan NaOH rắn vào nước để tạo thành hai dung dịch A và B với nồng độ phần trăm của dung dịch A gấp 3 lần nồng độ phần trăm của dung dịch B. Nếu đem pha trộn hai dung dịch A và B theo tỉ lệ khối lượng mA : mB = 5 : 2 thì thu được dung dịch C có nồng độ phần trăm là 20%. Nồng độ phần trăm của hai dung dịch A và B lần lượt là:
A. 24,7% và 8,24%
B. 24% và 8%
C. 27% và 9%
D. 30% và 10%.
373. Trộn V1 lit dung dịch HCI 0,6M với V2 lit dung dịch NaOH 0,4M thu được 0,6 lit dung dịch A. Biết rằng 0,6 lít dung dịch A có thể hoà tan hết 1,02g Al2O3. Thể tích Vì và V2 cần dùng là:
A. V1 = V2 = 0,28 lít
B. V1 = v2 = 0,3 lít
C. V1 = 0,22 lít; V2 = 0,38 lít
D. Tất cả đều sai.
374. Có những nguyên tố hoá học sau: đồng, cacbon, oxi, canxi, lưu huỳnh, thuỷ ngân, sắt, brom, nitơ, hiđro. Viết kí hiệu hoá học của:
a) Nguyên tố phi kim ở trạng thái rắn, lỏng, khí.
b) Nguyên tố kim loại ở trạng thái rắn, lỏng.
375. Một hợp chất X có 85,7%C, còn lại là nguyên tố H. Xác định công thức phân tử của hợp chất, biết hợp chất này có phân tử khối bằng phân tử khối khí nitơ.
376. Khi đốt nóng 1g sắt kết hợp với 1,9g clo tạo ra hợp chất sắt clorua. Tìm công thức của hợp chất sắt clorua, biết phân tử của hợp chất có một nguyên tử Fe.
377. Phân tích một hợp chất hoá học, thấy có 3 nguyên tố hoá học là C, H, và O. Đốt cháy hoàn toàn 1,24g hợp chất thì thu được 1,76g CO2 và 1,08g H2O. Xác định công thức phân tử của hợp chất, biết khối lượng mol của hợp chất bằng 62g.
378. Hợp chất nhôm sunfua trong thành phần có 36%Al và 64%S về khối lượng. Hãy tính hoá trị của Al trong hợp chất.
379. a) Tính khối lượng FeS thu được khi cho 8g bột s phản ứng với 28g bột Fe.
b) Cho công thức hoá trị của muối natri hiđrocacbonat NaHCO3. Hãy tính:
(1) Khối lượng của mỗi nguyên tố có trong 0,5 mol hợp chất.
(2) Tính số nguyên tử của mỗi nguyên tố có trong 0,5 mol hợp chất.
380. Đốt cháy 12g một mẫu cacbon không tinh khiết trong khí O2 dư thu được 16,8 lít khí CO2 (ở đktc). Hãy tính độ tinh khiết của mẫu cacbon trên.
381. Để sản xuất vôi sống CaO, người ta thường nung đá vôi CaCO3. Hãy tính hiệu suất của quá trình sản xuất vôi khi nung 10 tấn đá vôi thu được 4,48 tấn vôi sống.
382. Cho 8,125g Zn tác dụng vởi 18,25g axit clohiđric HCI. Hãy tính khối lượng ZnCl2 và thể tích khí H2 (đktc) tạo thành.
383. Cho biết các chất dưới đây thuộc loại hợp chất nào, viết công thức các chất đó: natri hiđroxit, khí cacbonic, khí sunturơ, sắt (III) oxit, muối ăn, axit clohiđric, axit photphoric.
384. Có ba lọ mất nhãn đựng các dung dịch sau: dung dịch axit, dung dịch kiềm NaOH, muối ăn. Làm thế nào để phân biệt các lọ bằng phương pháp hoá học?
385. Đốt cháy 6,8g một mẫu lưu huỳnh không tinh khiết trong khí oxi dư, người ta thu được 4,48 lít khí SO2 (ở đktc). Hãy tính độ tinh khiết của mẫu lừu huỳnh.
386. Cho 7,2g một loại oxit sắt tác dụng với khí hiđro cho 5,6g sắt. Tìm công thức oxit sắt.
387. Hãy viết phương trình các phản ứng hoá học tạo ra axit và bazơ từ các oxit mà em biết. Làm thế nào để nhận biết được dung dịch axit và dung dịch bazơ (mỗi loại oxit cho 5 ví dụ)?
388. Xác định công thức hoá học của một oxit của nhôm, biết tỉ số khối lượng của hai nguyên tố nhôm và oxi bằng 4,5 : 4.
389. Đốt nóng 0,675g bột nhôm trong khí clo, người ta thu được 3,3375g hợp chất nhôm clorua.
Xác định công thức hoá học của nhôm clorua. Giả sử chưa biết hoá trị của Al và Cl.
390. Đốt cháy hoàn toàn cacbon bằng lượng khí oxi dư, người ta được hỗn hợp khí cacbonic và khí oxi.
a) Xác định thành phần phần trăm theo số mol của khí oxi trong hỗn hợp có 0,3.1 023 phân tử CO2 và 0,9.1023 phân tử O2.
b) Trình bày phương pháp hoá học tách riêng khí oxi và khí cacbonic ra khỏi hỗn hợp.
391. Viết phương trình hoá học biểu diễn sự oxi hoá:
a) Đơn chất: Al, Cu, Fe, S, P, N.
b) Hợp chất: CH4, C2H2, C4H10, C2H6O (cồn đốt). Biết rằng sự oxi hoá các hợp chất này cho khí CO2 và H2O.
392. Đốt cháy hoàn toàn một hỗn hợp gồm khí co và khí H2 cần dùng 6,72 lít khí oxi và sinh ra 4,48 lít khí CO2. xác định thành phần phần trăm của hỗn hợp khí ban đầu theo số mol. Biết rằng các khí đều ở điểu kiện tiêu chuẩn.
393. Bình đựng gas dùng để đun nấu trong gia đình có chứa 12,76kg butan C4H10 ở trạng thái lỏng do được nén dưới áp suất cao. Tính thể tính không khí cần dùng (đktc) để đốt cháy hết lượng nhiên liệu có trong bình. Biết oxi chiếm 20% về thể tích có trong không khí.
394. Có 4 lọ mất nhãn đựng các khí sau: oxi, nitơ, không khí, khí cacbonic. Làm thế nào có thể phân biệt được các khí trong mỗi lọ bằng phương pháp hoá học?
395. Bốn bình có thể tích và khối lượng bằng nhau, mỗi bình đựng một trong những khí sau: oxi, hiđro, nitơ, khí cacbonic. Hãy cho biết số phân tử của mỗi khí và khối lượng khí có trong các bình có bằng nhau không? Giải thích. Biết các khí trên đều ở cùng điều kiện.
396. Có 4 lọ mất nhãn đựng một trong những chất lỏng không màu sau: nước muối, dung dịch axit suníuric, nước vôi trong, dung dịch NaOH. Nêu phương pháp hoá học phân biệt các chất lỏng đựng trong mỗi lọ và viết các phương trình phản ứng (nếu có).
397. So sánh thể tích khí hiđro sinh ra trong mỗi trường hợp sau:
a) 0,1 mol Fe tác dụng với dung dịch H2SO4 loãng, dư.
0,1 mol AI tác dụng với dung dịch H2SO4 loãng, dư.
b) 0,3 mol Zn tác dụng với dung dịch HCI dư.
0,3 mol AI tác dụng với dung dịch HCI dư.
398. Cần điều chế 5,6 lít khí hiđro (ở đktc) từ những chất có sẵn là magie, nhôm, sắt, axit clohiđric. Hãy chọn kim loại có khối lượng nhỏ nhất (axit dùng dư).
399. Khử hoàn toàn 10,86g một hỗn hợp gồm có CuO và PbO bằng khí hiđro, người ta thu được 1,8g H2O. Tính thành phần phần trăm về khối lượng các oxit trong hỗn hợp ban đầu. Tính thành phần phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu.
400. Tính thể tích (ở đktc) chất khử cần dùng và khối lượng kim loại thu được trong các thí nghiệm sau:
a) Khử hỗn hợp 20g CuO và 111,5g PbO ở nhiệt độ cao bằng khí hiđro.
b) Khử hỗn hợp 0,2 mol Fe2O3 và 0,1 mol Fe3O4 ở nhiệt độ cao bằng khí CO.
HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN
371. Đáp số đúng: C.
372. Đáp số đúng: A. Theo đầu bài ta có: Dung dịch A có nồng độ 3x%, dung dịch B có nồng độ x%.
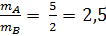 => mA = 2,5 mB
=> mA = 2,5 mB
Lấy dung dịch B là m gam, dung dịch A: 2,5m
mNaOH trong m gam B: 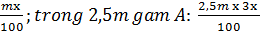
mx100+2,5m x 3x 100 2,5m+m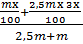 = 20100
= 20100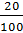
Giải ra ta có x = 8,24%; 3x = 24,7%
C% dung dịch A = 24,7%; C% dung dịch B: 8,24%.
nHCl = 0,6V1; nNaOH = 0,4V2; nAl2O3 = 0,01.
Trường hợp 1: HC1 dư
HC1 + NaOH -> NaCl + H2O
6HC1 + A12O3 -> 2A1Cl3 + 3H2O
0,4V2 + 0,06 = O,6V1 ; V1 + V2 = 0,6 => V1 = V2 = 0,3 lít.
Trường hợp 2: NaOH dư ,
NaOH + HC1 -> NaCl + H2O
2NaOH + Al2O3 -> 2NaA1O2 + H2O
O,6V1 + 0,02 = 0,4V2; V1 + V2 = 0,6
=> V1 = 0,22 lít và V2 = 0,38 lít
374. a) Nguyên tố phi kim: ở trạng thái rắn: C, S;
ở trạng thái khí: N, O, H ; ở trạng thái lỏng: Br.
b) Nguyên tố kim loại: ở trạng thái rắn: Cu, Ca, Fe; ở trạng thái lỏng: Hg.
375. MN2 = 14 x 2 = 28
Lượng C có trong phân tử hợp chất:
mC = 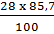 = 24; nC =
= 24; nC = 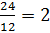 nguyên tử
nguyên tử
Lượng H có trong phân tử hợp chất:
mH = 28 - 24 = 4 => nH =  = 4 nguyên tử
= 4 nguyên tử
Công thức phân tử hợp chất là C2H4.
376. Theo đề bài cho phân tử sắt clorua có 1 nguyên tử Fe, nên ta có:
lg Fe kết hợp với l,9g Cl, vậy 56g Fe kết hợp với x g Cl
=> x = 106,4g ; nCl = 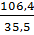 ≈ 3 nguyên tử
≈ 3 nguyên tử
Công thức phân tử hợp chất là FeCl3.
377. - Dựa vào mH2O, mCO2 tính mC, mH
- Dựa vào l,24g và mo, mn tính mo.
Trong 44g CO2 có 12g C, vậy trong l,76g CO2 có x g C => x = 0,48g
Trong 18g H2O có 2g H, vậy trong l,08g H2O có y g H => y = 0,12g
=> mo = 0,64
Cách 1: Tìm công thức phân tử hợp chất:
Giả sử công thức phân tử của hợp chất là CxHyOz, ta có:
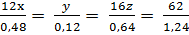
Giải ra ta có:
x = 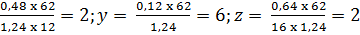
Công thức phân tử hợp chất là C2H6O2.
Cách 2: Đốt l,24g hợp chất cho 0,48g C, vậy đốt cháy 62g hợp chất cho 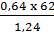 = 24 (g)
= 24 (g)
nC = 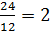 nguyên tử
nguyên tử
Đốt cháy l,2g hợp chất cho 0,12g H
Vậy đốt 62g hợp chất cho 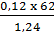 = 6(g); nH =
= 6(g); nH = 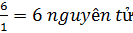
Đốt l,24g hợp chất cho 0,64g O
Vậy đốt 62g hợp chất cho 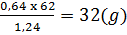
nO = 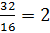 nguyên tử
nguyên tử
Công thức phân tử của hợp chất là C2H6O2.
378. Muốn tìm hoá trị của Al, ta phải tìm công thức phân tử của hợp chất. Đặt công thức phân tử hợp chất là AlxSy.
Ta có tỉ lệ: x : y = 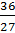 :
: 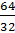 = 1,33 : 2 = 2 : 3
= 1,33 : 2 = 2 : 3
Công thức của hợp chất là Al2S3, trong hợp chất nguyên tố Al có hoá trị III, nguyên tố S có hoá trị II
| 379. a) Phương trình phản ứng: |
Fe + S -> FeS |
| |
56g |
32g |
88g |
| Đề bài cho |
28g |
28g |
|
Lập tỉ số  như vậy Fe dư, nên tính mFeS theo mS
như vậy Fe dư, nên tính mFeS theo mS
như vậy Fe dư, nên tính mpes theo ms
mFeS = (g)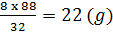 , chất còn dư là Fe: 28 -
, chất còn dư là Fe: 28 - 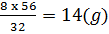
b) (1) Khối lượng của mỗi nguyên tố có trong 0,5 mol NaHCO3:
mNa = 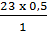 = 11,5 (g) ; mH = 0,5 (g) ; mC =
= 11,5 (g) ; mH = 0,5 (g) ; mC = 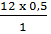 = 6 (g)
= 6 (g)
mO = 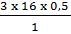 = 24 (g).
= 24 (g).
(2) Số nguyên tử của mỗi nguyên tố có trong 0,5 mol hợp chất NaHCO3:
Trong phân tử NaHCO3 ta nhận thấy: Na, C, H đều có 1 nguyên tử nên:
Số nguyên tử Na = số nguyên tử H = Số nguyên tử C và bằng 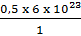 = 3.1023 nguyên tử
= 3.1023 nguyên tử
Số nguyên tử O = 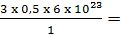 9.1023 nguyên tử
3 80. nCO2 =
9.1023 nguyên tử
3 80. nCO2 = 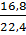 = 0,75 (mol)
= 0,75 (mol)
Phương trình phản ứng đốt cháy cacbon:
C + O2  CO2 CO2 |
| 1 mol |
1 mol |
1 mol |
| 0,75 mol |
|
0,75 mol |
mc = 0,75 x 12 = 9 (g)
Độ tinh khiết của mẫu cacbon: 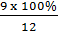 = 75%.
= 75%.
381. Phương trình hoá học của phản ứng nung đá vôi:
CaCO3  CaO + CO2 CaO + CO2 |
| 100g |
56g |
| 10T |
xT |
x = 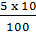 = 5,6T
= 5,6T
Nếu thu được 5,6T CaO thì hiệu suất đạt 100%, thực tế chỉ thu được 4,48T CaO thì hiệu suất của phản ứng nung đá vôi chỉ đạt:
H% = 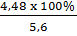 = 80%
= 80%
382. nZn = 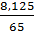 = 0,125 (mol); nHCl =
= 0,125 (mol); nHCl = 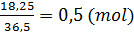
| Phương trình phản ứng: |
Zn + 2HCl -> ZnCl2 + H2 |
| |
1 mol |
2 mol |
|
1 mol |
| Theo đầu bài: |
0,125mol |
0,5 mol |
|
|
| Phản ứng: |
0,125 |
0,25 |
0,125 |
|
Lập tỉ số: 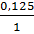 <
< 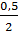 => nHCl dư nên tính nZnCL2 và nH2 theo nZn
=> nHCl dư nên tính nZnCL2 và nH2 theo nZn
(nghĩa là tính khối lượng ZnCl2, thể tích khí H2 theo khối lượng Zn).
mZnCl2 = 0,125 x 136 = 17 (g) ; VH2 = 0,125 x 22,4 = 2,8 (lít).
383. Các chất trên thuộc loại hợp chất sau:
- Oxit axit: khí cacbonic CO2; khí sunfurơ SO2.
- Oxit bazơ: sắt(III) oxit Fe2O3.
- Bazơ: natri hiđroxit NaOH.
- Axit: axit clohiđric HC1, axit photphoric H3PO4.
- Muối: muối ăn NaCl.
384. Cho giấy quỳ tím vào ba mẫu thử đựng các dung dịch trên. Dung dịch nào làm quỳ tím thành đỏ là dung dịch axit; lọ nào làm quỳ tím thành xanh là lọ đựng dung dịch kiềm. Còn lọ quỳ tím không đổi màu là lọ đựng dung dịch muối ăn NaCl.
Đang cập nhật....................