357. Độ tan của phân đạm 2 lá NH4NO3 ở 20°C là 192g. Ở nhiệt độ này dung dịch bão hoà NH4NO3 có nồng độ phần trăm là?
A. 60%
B. 34%
C. 65,75%
D. 70%.
Hãy giải thích sự lựa chọn.
358*. a) Cần lấy bao nhiêu gam NaOH cho thêm vào 120g dung dịch NaOH 20% để thu được dung dịch mới có nồng độ 25%?
b) Tính nồng độ phần trăm và nồng độ mol của dung dịch thu được sau khi hoà tan 12,5g CuSO4.5H2O vào 87,5ml nước. Biết thể tích dung dịch thu được bằng thể tích của nước.
359*. a) Cần thêm bao nhiêu gam nước vào 500 gam dung dịch NaCI 12% để có dung dịch 8%?
b) Phải pha thêm nước vào dung dịch H2SO4 50% để thu được một dung dịch 20%. Tính tỉ lệ về khối lượng giữa lượng nước và lượng dung dịch axit phải dùng.
c) Cần lấy bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam dung dịch CuSO4 4% để điểu chế 500g dung dịch CuSO4 8%?
360*. a) Cần lấy thêm bao nhiêu gam NaCL vào 500 gam dung dịch NaCL 8% để có dung dịch NaCL 12%?
b) Cho 124g Na2O vào 876mì nước. Tính nồng độ % của dung dịch sau khi chất tan tan hết.
c) Cần lấy bao nhiêu gam tinh thể CuSO4.5H2O và bao nhiêu gam nước để điều chế 500 gam dung dịch CuSO4 8%?
361. a) Đem hoà tan 246g muối FeSO4.7H2O vào nước thu được 1122g dung dịch FeSO4. Tính nồng độ phần trăm của dung dịch FeSO4?
b) Trộn 500 gam dung dịch HCI 3% vào 300g dung dịch HCI 10% thì thu được dung dịch có nồng độ bao nhiêu %?
c) Tính khối lượng NaCI kết tinh khi hạ nhiệt độ của 1800 gam dung dịch NaCI 30% ở 40°C xuống 20%. Biết độ tan ở 20°C là 36 gam.
362*. A là dung dịch HCL có nồng độ 0,3M. B là dung dịch HCL có nồng độ 0,6M.
a) Trộn A và B theo tỉ lệ thể tích VA : VB = 2 : 3 được dung dịch C. Hãy tính nồng độ mol của dung dịch C.
b) Phải trộn A và B theo tỉ lệ nào để được dung dịch HCI có nồng độ 0,4M?
363*. a) Làm bay hơi 75ml nước từ dung dịch H2SO4 có nồng độ 20% được dung dịch mới có nồng độ 25%. Hãy xác định khối lượng của dung dịch ban đầu. Biết Dnước = 1 g/ml.
b) Xác định khối lượng NaCL kết tinh trở lại khi làm lạnh 548g dung dịch muối ăn bão hoà ở 50°C xuống 0°c. Biết SNacl ở 50°C là 37g và SNacl ở 0°c là 35g.
364. Hoà tan 6 gam magie oxit vào 50ml dung dịch H2SO4 (D = 1,2 g/ml) thì vừa đủ.
a) Viết phương trình phản ứng xảy ra.
b) Tính khối lượng H2SO4 tham gia phản ứng.
c) Tính nồng độ phần trăm của dung dịch H2SO4.
d) Tính nồng độ phần trăm của dung dịch muối sau phản ứng.
365. Cho 150g CuSO4.5H2O vào 350ml nước tạo thành dung dịch A.
a) Tính nồng độ % dung dịch A thu được.
b) Lấy 1/4 khối lượng dung dịch A cho tác dụng với dung dịch NaOH 20%. Tính lượng dung dịch NaOH vừa đủ phản ứng với lượng dung dịch A đã lấy.
366. a) Cho 10 gam CaCO3 vào 182,5 gam dung dịch HCL 5%.
(1) Viết phương trình phản ứng.
(2) Tính nồng độ % các chất trong dung dịch thu được.
b) Cho 14,3 gam tinh thể Na2CO3.10H2O vào 200 gam dung dịch HCL 5%. Tính nồng độ % các chất trong dung dịch thu được.
367. Hoà tan một lượng oxit kim loại hoá trị (II) vào một lượng dung dịch H2SO4 có nồng độ 20% vừa đủ để tạo thành dung dịch muối sunfat có nồng độ 22,64%. Tìm công thức hoá học của oxit kim loại.
368. Trong phòng thí nghiệm, một em học sinh đổ một lọ đựng 150ml dung dịch HCL 10% có D là 1,047 g/ml vào lọ khác đựng 250ml dung dịch HCL 2M được dung dịch A. Theo em, dung dịch A có nồng độ mol nào sau đây?
A. 2M
B. 3M
C. 1,162M
D. 2,325M.
Hãy giải thích sự lựa chọn.
369. Hoà tan 336ml khí HCI (đktc) trong 200ml nước. Biết thể tích của dung dịch thay đổi không đáng kể. Nồng độ mol của dung dịch sau khi hoà tan là:
A. 0,05M
B. 0,025M
C. 0,075M
D.0,15M.
Hãy chọn đáp số đúng.
370. a) Để có được dung dịch NaCL 32% cần phải lấy bao nhiêu gam NaCI hoà tan trong 200g nước?
A. 90g
B. 141,18g
C. 94,12g
D. 100g
Hãy giải thích sự lựa chọn.
b) Để có được dung dịch KOH 32%, khối lượng nước cần dùng để hoà tan 40g KOH là:
A. 40g
B. 60g
C. 80g
D. 85g.
Hãy chọn đáp số đúng.
HƯỚNG DẪN GIẢI VÀ ĐÁP ÁN
357. Đáp số đúng: C
358*. a) Gọi x là số gam NaOH cần thêm vào, ta có:
mdd mới = 120 + x
Khối lượng NaOH có trong 120g dung dịch 20%:
mNaOH = 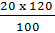 = 24 (g)
= 24 (g)
Sau khi cho x gam NaOH vào 120g dung dịch NaOH 20%:
mchất tan = 24 + x ; mdd = 120 + x .
Theo đề bài, ta có: 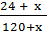 =
= 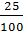
Giải phương trình trên, ta có x = 8 (g)
b) (1) Tính nồng độ phần trăm của dung dịch:
Trong 250g CuSO4.5H2O có 160g CuSO4
Trong 12,5g CuSO4.5H2O có xg CuSO4
x = 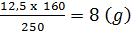 CuSO4
CuSO4
(2) Tính nồng độ mol của dung dịch:
Trong 250g CuSO4.5H2O có 90g H2O và 160g CuSO4
Trong 12,5g CuSO4.5H2O có xg H2O và yg CuSO4
x = 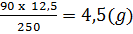 H2O; y =
H2O; y = 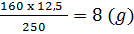 CuSO4
CuSO4
Vdd = 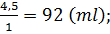 mdd = 12,5 + 87,5 = 100 (g)
mdd = 12,5 + 87,5 = 100 (g)
=> C%CuSO4 = 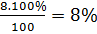
nCuSO4 = 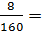 0,05 (mol) -> CM (CuSO4) =
0,05 (mol) -> CM (CuSO4) = 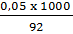 = 0.54M.
= 0.54M.
359*. a) - Trong 100 gam dung dịch có 12 gam NaCl
- Khối lượng NaCl trong 500 gam dung dịch NaCl 12%
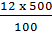 = 60 (g)
= 60 (g)
- Đặt khối lượng nước thêm vào là ag.
Khối lượng dung dịch: (500 + a)g
- Theo công thức tính nồng độ phần trăm ta có:
8% = 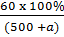
Giải ra ta có a = 250 (g).
b) Giả sử x là lượng nước phải dùng và y là lượng dung dịch H2SO4 50% phải dùng.
L00g dung dịch chứa 50g H2SO4
yg dung dịch chứa ag H2SO4
Lượng H2SO4 có trong yg dung dịch H2SO4 50% phải dùng là: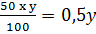
a = 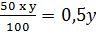 (g)
(g)
Khối lượng dung dịch H2SO4 20% thu được sau khi pha chế là: (x + y)g ; (x + y)g là khối lượng dung dịch sau khi đã pha thêm nước; 0,5y chiếm 20% khối lượng dung dịch.
Ta có tỉ lệ thức:
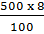 = 40 (g)
= 40 (g)
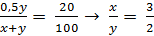
Tỉ lệ về khối lượng giữa lượng nước và lượng H2SO4 50% phải dùng để pha trộn là 3 : 2.
c) MCuSO4.5H2O = 250g; MCuSO4 = 160g
- Khối lượng CuSO4 trong 500 gam dung dịch 8%:
100 gam dung dịch có 8 g CuSO4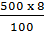 = 40 (g)
= 40 (g)
- Đặt a là khối lượng tinh thể CuSO4.5H2O cần lấy, ta có khối lượng dung dịch CuSO4 4% cần lấy là (500 - a)g
- Ta có phương trình:
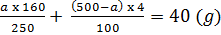
Giải ra ta có a = 33,33 gam tinh thể, và khối lượng dung dịch CuSO4 là 4% là: 466,67g.
360*. a) - Khối lượng NaCl trong 500 gam dung dịch NaCl 8%
100g dung dịch có 8g NaCl
500g dung dịch có 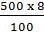 = 40 (g) NaCl
= 40 (g) NaCl
- Đặt a là khối lượng NaCl cần thêm vào
Khối lượng chất tan là (40 + a)g
Khối lượng dung dịch: (500 + a)g
- Theo công thức tính nồng độ phần trăm ta có:
12% = 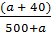 x 100%
x 100%
Giải ra ta có a = 22,7 g.
b) Phương trình phản ứng:
| Na2O + H2O -> 2NaOH |
62g
124g |
62g
xg |
x = 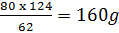
Khối lượng dung dịch: 876g nước + 124g Na2O = l000g
C% của dung dịch NaOH: 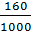 x 100% = 16%
x 100% = 16%
c) MCuSO4 = 160g; MCuSO4.5H2O = 250g
Khối lượng CuSO4 trong 500 gam dung dịch bằng:
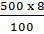 = 40 (g)
= 40 (g)
Khối lượng tinh thể CuSO4.5H2O cần lấy:
Trong 250g CuSO4.5H2O có 160g CuSO4
xg  40g CuSO4
40g CuSO4
x = 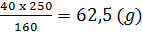
Khối lượng nước cần lấy 500 – 62,5 = 457,5 (g).
361. a) MFeSO4 = 152g; MFeSO4.7H2O = 278g
Lượng muối khan FeSO4 đem hoà tan là:
Trong 278g FeSO4.7H2O có 152g FeSO4
246g  xg
xg
x = 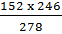
C% dung dịch là: 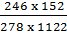 x 100% = 12%.
x 100% = 12%.
b) – Khối lượng HCl trong 500g dung dịch 3%: 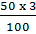
- Khối lượng HC1 trong 300g dung dịch 10%: 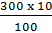
- Tính theo công thức tính nồng độ phần trăm:
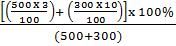 = 5,625%
= 5,625%
c) Khối lượng NaCl trong 1800 g dung dịch 30%
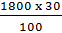 = 540 (g)
= 540 (g)
Khối lượng nước: 1800 - 540 = 1260 (g)
Khối lượng muối tan bão hoà trong 1260g nước ở 20°C:
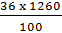 = 453,6 (g)
= 453,6 (g)
Lượng muối kết tinh: 540 - 453,6 = 86,4 (gam).
362*. a) nHCl có trong 2V (ml) dung dịch A:
nHCl = 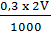 = 0,0006V (mol)
= 0,0006V (mol)
nHCl có trong 3V (ml) dung dịch B:
nHCl = 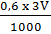 = 0,0018V (mol)
= 0,0018V (mol)
Nồng độ mol của dung dịch sau khi pha trộn:
CM = 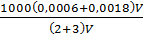 = 0,48(mol/l)
= 0,48(mol/l)
b) Gọi x (mol) và y (mol) là thể tích dung dịch axit A và B phải lấy để có dung dịch HCl 0,4M.
nHCl có trong x(ml) dung dịch A là: nHCl A = 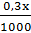 = 0,0003x (mol)
= 0,0003x (mol)
nHCl có trong y(ml) dung dịch B là: nHCl B = 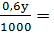 0,0006y (mol)
0,0006y (mol)
Theo công thức tính nồng độ mol ta có:
0,4 = 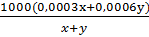
Giải phương trình trên ta tìm được tỉ lệ x và y (học sinh tự giải).
363*. a) 75ml nước = 75g. Gọi m là khối lượng dung dịch ban đầu.
- Khối lượng của dung dịch sau khi làm bay hơi nước: (m - 75)
- Ta có phương trình khối lượng chất tan: 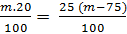
Giải ra ta có m = 375g.
b) Cách 1:
- Ở 50°C: Trong (100 + 37)g dung dịch NaCl bão hoà có 37g NaCl. Vậy trong 548g dung dịch NaCl bão hoà có xg NaCl
x = 148g ; mH2O = 548 - 148 = 400 (g)
- Ở 0°C: l00g nước hoà tan 35g NaCl
400g nước hoà tan y g NaCl
y = 140g, khối lượng NaCl kết tinh trở lại: 148 - 140 = 8g.
Cách 2: Gọi x là khối lượng NaCl có trong 548g dung dịch bão hoà, vậy khối lượng nước là (548 - x).
Trong l00g nước hoà tan 37g, vậy trong (548 - x)g hoà tan xg.
x = 148g (sau đó giải như cách 1).
Cách 3: Làm lạnh 137g dung dịch bão hoà (từ 50°C xuống 0°C) thì khối lượng dung dịch giảm 37 - 35 = 2 (g). Như vậy có 2g kết tinh.
137g dung dịch NaCl (từ 50oC xuống 0oC) kết tinh 2g
548g dung dịch NaCl (từ 50°C xuống 0°C) kết tinh xg
x = 8g.
364. a) nMgO =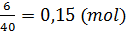
| MgO + H2SO4 → MgSO4 + H2O |
1 mol
0,15 mol |
1 mol
0,15 mol |
1 mol
0,15 mol |
b) mH2SO4 = 0,15 x 98 = 14,7 (g)
c) Khối lượng dung dịch H2SO4: 50 x 1,2 = 60 (g).
C% của dung dịch H2SO4: 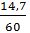 x 100% = 24,5%
x 100% = 24,5%
d) Khối lượng dung dịch muối sau phản ứng: 60 + 6 = 66 (g)
Khối lượng MgSO4: 0,15 x 120 = 18 (g)
C% của dung dịch MgSO4: 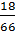 x 100% = 27,27%
x 100% = 27,27%
365. a) Một mol CuSO4.5H2O có khối lượng 250 gam.
Cứ 250 gam CuSO4.5H2O có 160 gam CuSO4 nguyên chất.
Vậy 150 gam CuSO4.5H2O có x g CuSO4 nguyên chất.
x = 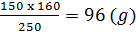
Khối lượng dung dịch A = (150 + 350)g (nước) = 500 (g)
C%(A) = 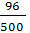 x 100% = 19,2%
x 100% = 19,2%
b) Lấy 1/4 khối lượng dung dịch A thì khối lượng CuSO4 nguyên chất là:
96 : 4 = 24 (g) ; nCuSO4 =  = 0,15 (mol)
= 0,15 (mol)
Cho dung dịch NaOH vào dung dịch A ta có phản ứng:
| CuSO4 + 2NaOH -> Cu(OH)2↓ + Na2SO4 |
1 mol
0,15 mol |
1 mol
0,3 mol |
|
mNaOH = 0,3 x 40 = 12 (g)
Khối lượng NaOH nguyên chất cần là 12g. Vậy khối lượng dung dịch 20% chứa 12g là:
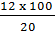 = 60 (g) dung dịch.
= 60 (g) dung dịch.
366. a) mHCl = 182,5 x 5% = 9,125 (g) -> nHCl = 0,25 (mol)
nCaCO3 = 10100= 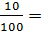 0,1 (mol)
0,1 (mol)
(1) CaCO3 + 2HCl -> CaCl2 + H2O + CO2↑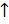 |
| Theo PTHH: |
1 mol |
2 mol |
1 mol |
1 mol |
| Theo đề bài: |
0,1 mol |
0,25 mol |
|
|
| Phản ứng: |
0,1 mol |
0,2 mol |
0,1 mol |
0,1 mol |
| Sau phản ứng: |
0 |
0,05 mol |
0,1 mol |
0,1 mol |
-> mHCl dư = 0,05 x 36,5 = 1,825 (g)
mCaCl2 = 0,1 x 111 = : 11,1 (g) ; mCO2 = 0,1 x 44 = 4,4 (g)
mdd sau phản ứng = 10 + 182,5 – 4,4 = 188,1 (g)
C%HC1 = 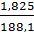 x 100% = 0,97%
x 100% = 0,97%
C%CaCl2 = 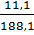 x 100% = 5,9%
x 100% = 5,9%
b) Đáp số: C%(HC1) = 3% ; C% (NaCl) = 2,76%.
367. Đặt M là nguyên tử khối của kim loại hoá trị II.
MO + H2SO4 -> MSO4 + H2O
Khối lượng dung dịch: 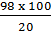 + (M + 16)
+ (M + 16)
Khối lượng muối M + 96
Nồng độ % dung dịch muối: 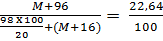
Giải ra ta có M = 24. Công thức oxit kim loại MgO.
368. Đáp số đúng: D.
- Tính khối lượng HC1 từ đó suy ra số mol HC1 có trong lọ thứ nhất.
- Tính số mol HCl có trong lọ thứ hai
- Nồng độ mol của dung dịch A = 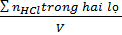
369. Đáp số đúng: C.
370. a) Đáp số đúng: C.
b) Đáp số đúng: D.