1. Định nghĩa: Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
2. Các loại nồng độ và sự chuyển đổi nồng độ
a) Nồng độ phần trăm và nồng độ mol
| |
Nồng độ |
| |
Phần trăm (C%) |
Mol (CM) |
| Chất tan |
mct |
|
| Dung dịch |
mdd |
|
| Công thức |
C% = 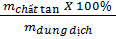 |
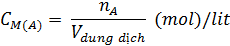
|
b) Sự chuyển đổi giữa nồng độ phần trăm và nồng độ mol
- Công thức chuyển từ nồng độ phần trăm (C%) sang nồng độ mol (CM)
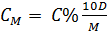
D là khối lượng riêng của dung dịch g/ml
M là phân tử khối của chất tan
- Chuyển từ nồng độ mol (CM) sang nồng độ phần trăm (C%)
c) Chuyển đổi giữa khối lượng dung dịch và thể tích dung dịch
- Thể tích của chất rắn và chất lỏng: V = 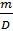
Trong đó D là khối lượng riêng: D (g/cm3) có m (g) và V (cm3 hay ml);
D (kg/dm3) có m (kg) và V (dm3 hay lít).
3. Pha trộn dung dịch
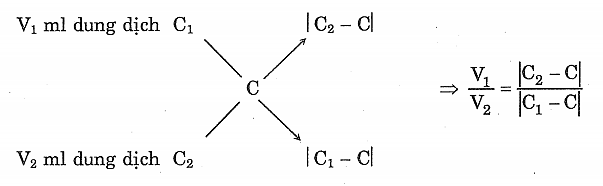
a) Phương pháp đường chéo
Khi pha trộn 2 dung dịch cùng loại nồng độ, cùng loại chất tan thì có thể dùng phương pháp đường chéo.
- Trộn m1 gam dung dịch có nồng độ C1% với m2 gam dung dịch có nồng độ C2% thì thu được dung dịch mới có nồng độ C%:
m1 gam dung dịch

- Trộn V1 ml dung dịch có nồng độ Cl mol với V2 ml dung dịch có nồng độ C2 mol thì thu được dung dịch mới có nồng độ C mol và giả sử có thể tích V1 + V2 ml:
- Sơ đồ đường chéo còn có thể áp dụng trong việc tính khối lượng riêng D
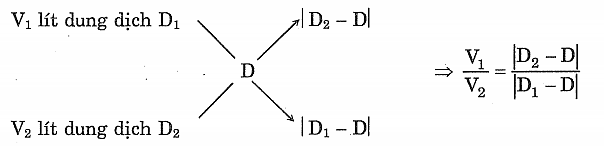
(Với giả thiết V = V1 + V2)
b) Dùng phương trình pha trộn
m1C1 + m2C2 = (m1 + m2)C
m1 và m2 là số gam dung dịch thứ 1 và dung dịch thứ 2
Cl và C2 là nồng độ % dung dịch thứ 1 và dung dịch thứ 2
C là nồng độ dung dịch mới
m1(C1 - C) = m2(C - C2)
C1 > C > C2
Từ phương trình trên rút ra: 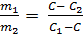
Lưu ý: Khi pha trộn các dung dịch, cần chú ý:
Có xảy ra phản ứng giữa các chất tan hoặc giữa chất tan với dung môi không? Nếu có, cần phân biệt chất đem hoà tan với chất tan.
Ví dụ: Cho Na2O hay SO3 vào nước.
Na2O + H2O -> 2NaOH
SO3 + H2O —> H2SO4
Khi chất tan phản ứng với dung môi, phải tính nồng độ của sản phẩm chứ không phải tính nồng độ của chất tan đó.
Ví dụ: Cần thêm bao nhiêu gam SO3 vào 100 gam dung dịch H2SO4 10% để được dung dịch H2SO4 20%?
Hướng dẫn cách giải: Gọi số mol SO3 cho thêm vào là X
| SO3 + H2O —> |
H2SO4 |
| x mol |
x mol |
mH2SO4 tạo thành 98x, mSO3 cho thêm vào 80x
C% dung dịch mới: 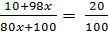
Giải ra ta có x = 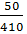 mol => mSO3 thêm vào 9,756 gam
mol => mSO3 thêm vào 9,756 gam
Có thể giải theo phương trình pha trộn như đã nêu ở trên.
4. Tính nồng độ các chất trong trường hợp các chất tan có phản ứng với nhau
1/ Viết phương trình phản ứng hoá học xảy ra để biết chất tạo thành sau phản ứng.
2/ Tính số mol (hoặc khối lượng) của các chất sau phản ứng.
3/ Tính khối lượng hoặc thể tích dung dịch sau phản ứng.
Cách tính khối lượng dung dịch sau phản ứng:
- Nếu chất tạo thành không có chất bay hơi hay kết tủa
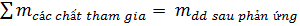
- Nếu chất tạo thành có chất bay hơi hay kết tủa
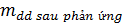 =
= 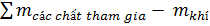
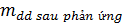 =
= 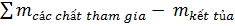
Hoặc: 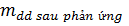 =
= 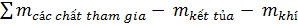
Chú ý: Trường hợp có 2 chất tham gia phản ứng đều cho biết số mol (hoặc khối lượng) của 2 chất, thì lưu ý có thể có một chất dư. Khi đó tính số mol (hoặc khối lượng) chất tạo thành phải tính theo lượng chất không dư.
4/ Nếu đầu bài yêu cầu tính nồng độ % các chất sau phản ứng, nên tính khối lượng chất trong phản ứng theo số mol, sau đó từ số mol quy ra khôi lượng để tính nồng độ %.
5. Sự chuyển từ độ tan sang nồng độ phần trăm và ngược lại
- Chuyển từ độ tan ra nồng độ phần trăm: Dựa vào định nghĩa độ tan, từ đó tính khối lượng dung dịch, suy ra số gam chất tan trong l00g dung dịch.
- Chuyển từ nồng độ phần trăm sang độ tan: Từ định nghĩa nồng độ phần trăm, suy ra khối lượng nước, khối lượng chất tan, từ đó tính l00g nước chứa bao nhiêu gam chất tan.
- Biểu thức liên hệ giữa độ tan (S) và nồng độ phần trăm của chất tan trong dung dịch bão hoà:
C% = 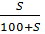 x 100%
x 100%
6. Bài toán về khôi lượng chất kết tinh
Khối lượng chất kết tinh chỉ tính khi chất tan đã vượt quá độ bão hoà của dung dịch.
7. Khi gặp dạng bài toán làm bay hơi c gam nước từ dung dịch có nồng độ a% được dung dịch mới có nồng độ b%. Hãy xác định khôi lượng của dung dịch ban đầu (biết b% > a%).
Gặp dạng bài toán này ta nên giải như sau:
- Lập được phương trình khối lượng chất tan trước và sau phản ứng.
- Giả sử khối lượng của dung dịch ban đầu là m gam
Ta có phương trình:
Khối lượng chất tan = 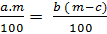
Giải phương trình trên ta có: m = 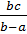 (g).
(g).