KIẾN THỨC CẦN NHỚI. VỊ TRÍ CỦA KIM LOẠI TRONG BẢNG TUẦN HOÀN Trong bảng tuần hoàn, các nguyên tố kim loại có mặt ở:
- Nhóm I
A (trừ hiđro) và II
A. Các kim loại này là những nguyên tố s.
- Nhóm III
A (trừ bo), một phần cùa các nhóm IV
A, V
A, VI
A. Các kim loại này là những nguyên tố p.
- Các nhóm B (từ IB đến VIIIB). Các kim loại nhóm B được gọi là những kim loại chuyển tiếp, chúng là những nguyên tố d.
- Họ lantan và actini. Các kim loại thuộc hai họ này là những nguyên tố f. Chúng được xếp riêng thành hai hàng ờ cuối bảng.
Xác định vị trí nguyên tố:
+ Nguyên tố thuộc phân nhóm chính (nhóm A): có electron xép sau cùng rơi vào phân lớp s hoặc p.
- Số thứ tự = Z
- Chu kỳ = số lớp electrron
- Nhóm = tổng số số electron ở lớp ngoài cùng
+ Nguyên tố thuộc phân nhóm phụ (nhóm B): có electron xếp sau cùng rơi vào phân lớp d.
- Số thứ tự = Z
- Chu kỳ = số lớp electrron
- Nhóm = phụ thuộc tổng số số electron ở lớp (n - 1 )d
x + ns
y = S
+ Khi 1 ≤ S ≤ 8 thì số nhóm bằng S
+ Khi 8 < S ≤ 10 thì sổ nhóm là VIII
B+ Khi 10 < S thì số nhóm = S – 10
II. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI Tính chất vật lí chung là tính dẻo, tính dẫn điện, tính dẫn nhiệt và ánh kim.
- Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, Sn,... (dẻo nhất là Au)
- Độ dẫn điện của Ag > Cu > Au > Al > Fe
- Nhiệt độ tăng thì tính dẫn điện cùa kim loại giảm.
- Kim loại nào dẫn điện tốt thì cũng dẫn nhiệt tốt. Tính dẫn nhiệt của kim loại giảm dần theo thứ tự Ag, Cu, Al, Fe,...
- Khối lượng riêng: Li là kim loại có khối lượng riêng nhỏ nhất, D = 0,5g/cm
3.
- Kim loại có khối lượng riêng lớn nhất là osimi (Os), D = 22,6g/cm
3.
- Kim loại có khối lượng riêng nhỏ hơn 5g/cm
3 là những kim loại nhẹ, như: Na, K, Mg, Al,... Những kim loại có khối lượng riêng lớn hơn 5g/cm3 là những kim loại nặng, như: Fe, Zn, Pb, Cu, Ag, Hg,...
- Kim loại có nhiệt độ nóng chảy rất khác nhau. Thấp nhất là Hg nóng chảy ờ -39°c, cao nhất là W (vonfam) nóng chảy ở 3410°c.
- Tính cứng: mềm nhất là Cs (0,2), cứng nhất là Cr (9).
Mạng tinh thể Lập phương tâm khối
Độ đặc khít 68% | Lập phương tâm diện
Độ đặc khít 74% | Lục phương
Độ đặc khít 74% |
| Li, Na, K, Rb, Cs | | |
| Ba | Ca, Sr | Be, Mg |
| Cr | Al | |
| Fe (α) | Fe (γ) | |
| V, Mo | Cu | |
| Ni, Pb | Au, Ag | Zn |
III. HOÁ TÍNH:TÍNH CHẤT HOÁ HỌC ĐẶC TRƯNG CỦA KIM LOẠI LÀ TÍNH KHỬ M => Mn+ + ne 1. Tác dụng với phi kim: hầu hết các kim loại khử được phi kim thành ion âm
2Na + Cl
2 => 2NaCl
Mg + Cl
2 => MgCl
22Al + 3Cl
2 => 2AlCl
32Cr + 3Cl
2 => 2CrCl
3Fe + S => FeS
2Fe + 3Cl
2 => 2 FeCl
32Fe + 3Br
2 => 2 FeBr
3Fe + I
2 => FeI
22. Tác dụng với oxi: Ag, Au, Pt không tác dụng
4Li + O
2 => 2Li
2O
2Na + O
2 => Na
2O
2 (cháy trong oxi khô)
2Mg + O
2 => 2MgO
4Al + 3O
2 => 2Al
2O
33Fe + 2O
2 => Fe
3O
44Cr + 3O
2 => 2Cr
2O
3 3. Tác dụng với axit:a. Axit thông thường: HCl, H
2SO
4 loãng... tác dụng với kim loại đứng trước H cho H
2 bay lên
2Li + 2HCl => 2LiCl + H
2↑
Zn + 2HCl => ZnCl
2 + H
2↑
Fe + 2HCl => FeCl
2 + H
2↑
Cr + 2HCl => CrCl
2 + H
2↑
2Al + 6HCl => 2AlCl
3 + 3H
2↑
(các kim loại có tính khử mạnh như K, Na... sẽ gây nổ khi tiếp xúc với các dung dịch axit)
b. Axit có tính oxi hoá mạnh: H
2SO
4 đặc, HNO
3- HNO
3 đặc/nguội, H
2SO
4 đặc nguội: không tác dụng và đồng thời làm thụ động các kim loại Al, Fe, Cr.
- HNO
3, H
2SO
4 đặc: không tác dụng Au, Pt
- Hầu hết các kim loại tác dụng, khử được N
+5 và S
+6 xuống số oxi hoá thấp hơn
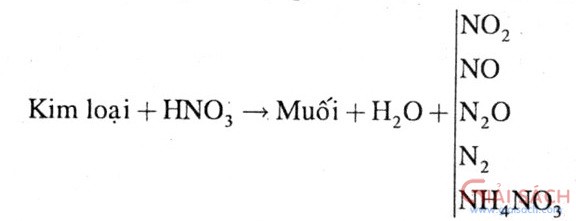
Kim loại trung bình hoặc yếu tác dụng với HNO
3 đặc nóng tạo NO
2, loãng tạo NO
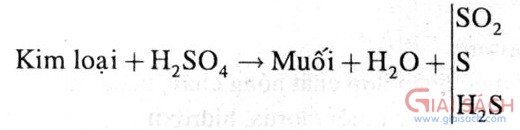
3Cu + 8HNO
3 => 3Cu(NO
3)
2 + 2NO + 4H
2O
2Fe + 6H
2SO
4 đặc , nóng => Fe
2(SO
4)
3 + 3SO
2 + 6H
2O
4. Tác dụng với dung dịch muối: Tuân theo quy tắc α:
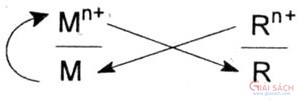
0 +2 +2
Fe +CuSO
4 => FeSO
4 +Cu↓
Cu + 2FeCl
3 => CuCl
2 + 2FeCl
2Fe(NO
3)
2 + AgNO
3 => Fe(NO
3)
3 + Ag ↓
Fe + 2Fe(NO
3)
3 => 3Fe(NO
3)
2 Cần chú ý: 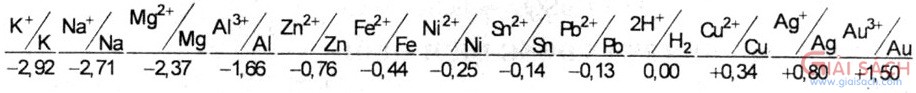
Các kim loại có khả năng tác dụng với nước ở ngay điều kiện thường như: Na, K, Ca, Ba... khi cho vào dung dịch muối sẽ tác dụng với nước trước, tạo dung dịch bazơ. Phản ứng tiếp theo nếu có là của dung dịch bazơ với dung dịch muối.
5. Tác dụng với dung dịch bazơ: Do dung dịch bazơ phá vỡ lớp bảo vệ, kim loại tác dụng với nước tạo hiđroxyt bảo vệ, lớp này tiếp tục bị dung dịch bazơ phá vỡ. Các kim loại thường gặp là Al, Be, Zn.
2Al + 2NaOH + 2H
2O => 2NaAlO
2 + 3H
2↑
6. Tác dụng với nước: ở điều kiện thường
Bao gồm các kim loại Li, Na, K, Rb, Cs, Ca, Sr, Ba. Tạo dung dịch bazơ và H
2O
2Na + 2H
2O => 2NaOH + H
2↑
Ca + 2H
2O => Ca(OH)
2 + H
2↑
ĐIỀU CHẾ KIM LOẠI Nguyên tắc: khử ion dương kim loại thành kim loại.
Chia thành 2 nhóm chính:
Nhóm 1: Kim loại hoạt động mạnh
Chỉ sử dụng được phương pháp điện phân hợp chất nóng chảy, bao gồm:
- Kim loại kiềm: điện phân nóng chảy muối clorua, hiđroxit
- Kim loại kiềm thổ: điện phân nóng chảy muối clorua
- Nhôm: điện phân nóng chảy Al
2O
3 Nhóm 2: bao gồm các kim loại đứng sau nhôm
ĐIỀU CHẾ BẰNG PHƯƠNG PHÁP NHIỆT LUYỆN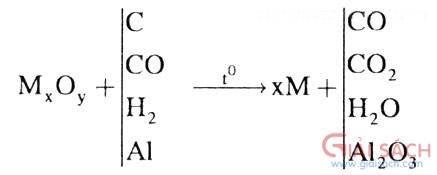
t
o FeO + CO => Fe + CO
2Cần chú ý: số mol CO = số mol CO
2; số mol H
2 = số mol H
2O
ĐIỀU CHẾ BẰNG PHƯƠNG PHÁP THUỶ LUYỆN Dùng kim loại có tính khử mạnh đẩy kim loại có tính khử yếu ra khỏi dung dịch muối cùa chúng:
Fe + CuSO
4 => FeSO
4 + Cu
ĐIỀU CHẾ BẰNG ĐIỆN PHÂN DUNG DỊCH MUỐI Cation:- Là ion của kim loại đứng sau AI sẽ bị khử thành kim loại
M
n+ + ne => M
- Là ion của kim loại mạnh (hoặc NH
4+) sẽ không bị điện phân. Lúc này nước bị điện phân
2H
2O + 2e => H
2 + 2OH
-ĐIỀU CHẾ BẰNG ANION- Nếu là Cr
-, Br
- sẽ tạo thành Cl
2, Br
2- Nếu là gốc ayxit có oxi: SO
24 , NO
3 ... sẽ không bị điện phân. Lúc này nước bị điện phân:
2H
2O => O
2 + 4H
+ + 4e
dpdd
Ví dụ: CuCl
2 --------> Cu + Cl
2 TÊN VÀ CÔNG THỨC MỘT SỐ CHẤT 1. Xinvinit NaCl.KCl
2. Cacnalit KCl.MgCl
2.6H
2O
3. Đolomit CaCO
3.MgCO
34. Apatit Ca
3(PO
4)
2.CaF
25. Boxit Al
2O
3.nH
2O
6. Đất sét Al
2O
3 2SiO
2.2H
2O
7. Mica K
2O.Al
2O
3.6SiO
2.2H
2O
8. Criolit Na
3AlF
6 (hay AlF
3.3NaF)
9. Pirit đồng CuFeS
210. Malachit Cu(OH)
2.CuCO
311. Chancozit Cu
2S
12. Manhetit Fe
3O
413. Hemantit đỏ Fe
2O
314. Hemantit nâu Fe
2O
3.nH
2O
15 Xiderit FeCO
316. Pirit sắt FeS
217. Phèn chua Al
2(SO
4)
3.K
2SO
4.24H
2O
18. Phèn nhôm amon Al
2(SO
4)
3.(NH
4)
2SO
4.24H
2O
19. Galen PbS
20. Sphalerit ZnS.FeS (Zn là chủ yếu)
21. Fluorit CaF
222. Crômit FeO.Cr
2O
3 hay Fe(CrO
2)
223. Thạch cao sống CaSO
4.2H
2O
24. Vôi sống CaO
25. Vôi tôi Ca(OH)
2 TÍNH CHẤT LƯỠNG TÍNHChất lưỡng tính là chất vừa thể hiện tính chất axit vừa thể hiện tính chất bazơ, do đó vừa tác dụng với axit vừa tác dụng được với bazơ theo phản ứng axit bazơ (phản ứng trao đổi).
Một số hợp chất lưỡng tính thường gặp: | Oxit | Al2O3, BeO, ZnO, Cr2O3 |
| Hiđroxit | Al(OH)3, Be(OH)2, Zn(OH)2, Cr(OH)3 |
| Muối axit của axit yếu | NaHCO3, Ca(HCO3)2, NaHS, Ba(HCO3)2 |
| Muối của axit yếu và bazơ yếu | (NH4)2CO3, CH3COONH4, NH4HCO3 |
MỘT SỐ TRƯỜNG HỢP CẦN CHÚ Ý THÊM 1. CO2 tác dụng với chất khác Thí nghiệm: Cho CO
2 từ từ đến dư vào dung dịch Ca(OH)
2 hoặc Ba(OH)
2. Hiện tượng: Xuất hiện kết tủa, sau đó kết tủa tan.
CO
2 + Ca(OH)
2 => CaCO
3↓ + H2O
CaCO
3 + CO
2 + H
2O => Ca(HCO
3)
2 Thí nghiệm: Cho CO
2 từ từ đến dư vào dung dịch NaOH.
Phản ứng xảy ra:
CO
2 + 2NaOH => Na
2CO
3 + H
2O
Na
2CO
3 + CO
2 + H
2O => 2NaHCO
3 2. Muối nhôm Thí nghiêm: Dẫn CO
2 đến dư vào dung dịch NaAlO
2.
Hiện tượng: Xuất hiện kết tủa keo trắng không tan khi CO
2 dư.
CO
2 + H
2O + NaAlO
2 => Al(OH)
3↓ + NaHCO
3 Thí nghiệm: Cho dung dịch HCl từ từ đến dư vào dung dịch NaAlO
2.
Hiện tượng: Xuất hiện kết tủa keo trắng, sau đó tan khi HCl dư.
HCl + H
2O + NaAlO
2 => Al(OH)
3↓ + NaCl
Al(OH)
3 + 3HCl => AlCl
3 + 3H
2O
Thí nghiệm: Cho từ từ dung dịch NaOH cho đến dư vào dung dịch AlCl
3.
Hiện tượng: Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan dần tạo dung dịch trong suốt.
AlCl
3 + 3NaOH => Al(OH)
3↓ + 3NaCl
Al(OH)
3 + NaOH => NaAlO
2 + 2H
2O
Hiện tượng này tương tự với ZnCl
2, CrCl
3.
Thí nghiệm: Cho từ từ dung dịch AlCl3 đến dư vào dung dịch NaOH.
Hiện tượng: Xuất hiện kết tủa keo trắng sau đó tan ngay (vì nằm trong môi trường NaOH), một thời gian sau lại xuất hiện kết tủa keo trắng không tan.
AlCl
3 + 3NaOH => Al(OH)
3↓ + 3NaCl
Al(OH)
3 + NaOH => NaAlO
2 + 2H
2O
Thí nghiệm: Cho từ từ dung dịch NH
3 vào dung dịch AlCl
3.
Hiện tượng: Tạo kết tủa keo trắng không tan trong dung dịch NH
3 dư.
AlCl
3 + 3NH
3 + 3H
2O => Al(OH)
3 ↓ + 3NH
4Cl
Thí nghiệm: Cho Na vào dung dịch AlCl
3Hiện tượng: Có khí bay lên, tạo kết tủa trắng. Đôi khi kết tủa có thể tan:
2Na+ 2H
2O => 2NaOH + H
2↑
AlCl
3 + 3NaOH => Al(OH)
3 ↓+ 3NaCl
Nếu dung dịch còn dư NaOH thì:
Al(OH)
3 + NaOH => NaAlO
2 + 2H
2O
3. Liên quan Na2CO3 Thí nghiệm: Cho từ từ đến dư dung dịch HC1 vào dung dịch Na2CO3 Hiện tượng: Lúc đầu không có CO
2 bay lên, một lúc sau bắt đầu có CO
2↑
HCl + Na
2CO
3 => NaHCO
3 + NaCl
HCl + NaHCO
3 => NaCl + H
2O + CO
2↑
Thí nghiệm: Cho từ từ đến dư dung dịch Na
2CO
3 vào dung dịch HCl
Hiện tượng: Xuất hiện CO
2 ngay lập tức (vì Na
2CO
3 nằm trong môi trường axit)
2HCI + Na
2CO
3 => 2NaCl + H
2O + CO
2 Thí nghiệm: Cho dung dịch FeCl3 tác dụng với dung dịch Na
2CO
3Hiện tượng: Có kết tủa nâu đỏ và khí bay lên:
2FeCl
3 + 3Na
2CO
3 => Fe
2(CO
3)
3 + 6NaCl
Fe
2(CO
3)
3 + 3H
2O => 2Fe(OH)
3 ↓+ 3CO
2↑
Thí nghiệm: Cho dung dịch AlCl3 tác dụng với dung dịch Na
2CO
3Hiện tượng: Có kết tủa keo trắng và khí bay lên:
2AlCl
3 + 3Na
2CO
3 => Al
2(CO
3)
3 + 6NaCl
Al
2(CO
3)
3 + 3H
2O => 2Al(OH)
3↓ + 3CO
2↑
4. Liên quan đến kim loại Oxit kim loại tác dụng với H2O ở nhiệt độ thường Thí nghiệm: Cho K vào dung dịch CuSO
4Hiện tượng: Có khí bay ra và xuất hiện kết tủa màu xanh:
2K + 2H
2O => 2KOH + H
2↑
2KOH + CuSO
4 => Cu(OH)
2↓ + K
2SO
4Thí nghiệm: Cho Na
2O vào dung dịch CuSO
4Hiện tượng: Xuất hiện kết tủa màu xanh
Na
2O + H
2O => 2NaOH
2NaOH + CuSO
4 => Cu(OH)
2↓ + Na
2SO
4 5. Liên quan dãy điện hóaThí nghiệm: Cho Fe dư tác dụng với dung dịch HNO
3 loãng
Kết quả: Thu được muối sắt (II)
Fe + 4HNO
3 => Fe(NO
3)
3 + NO + 2H
2O
Fe + 2Fe(NO
3)
3 => 3Fe(NO
3)
2 Thí nghiệm: Cho Fe tác dụng dung dịch AgNO
3 dư
Kết quả: Thu được muối sắt (III) màu vàng và có Ag kết tủa
Fe + 2AgNO
3 => Fe(NO
3)
2 + 2Ag↓
Fe(NO
3)
2 + AgNO
3 => Fe(NO
3)
3 + Ag↓
Thí nghiêm: Cho Cu dư vào dung dịch muối sắt (III)
Hiện tượng: Mất dần màu vàng, xuất hiện màu xanh
Cu + 2FeCl
3 => CuCl
2 + 2FeCl
2 Thí nghiệm: Hoà tan hỗn hợp Fe
3O
4 và Cu trong dung dịch HCl dư
Kết quả: Thu được FeCl
2 và CuCl
2, nếu sau còn đồng dư thì không còn FeCl
3 Fe
3O
4 + 8HCl => FeCl
2 + 2FeCl
3 + 4H
2O
Cu + 2FeCl
3 => CuCl
2 + 2FeCl
2 6. Liên quan dung dịch NH3 Thí nghiệm: Cho từ từ đến dư dung dịch NH
3 vào dung dịch CuCl
2 Hiện tượng: Xuất hiện kết tủa xanh sau đó tan, tạo dung dịch xanh lam
CuCl
2 + 2NH
3 + 2H
2O => Cu(OH)
2↓ + 2NH
4CI
Cu(OH)
2 + 4NH
3 => [Cu(NH
3)
4](OH)
2